
(1)该工艺流程中多处涉及到过滤操作,其要运用到的玻璃仪器首要有烧杯、玻璃棒、(一般)漏斗.
(2)假定所得反响Ⅰ的滤液中各种金属阳离子的浓度均为0.001mol/L(查数据可知部分难溶物的溶度积Ksp数值如下表所示(25℃))
②当Fe3+刚好沉积彻底时溶液的PH值为3.3.(已知:lg2=0.3)
过程1:精确称取样品ag,参加适量KOH固体,在高温下充沛灼烧,冷却,加水溶解.
过程3:向硅酸浊液中参加NH4F溶液、饱满KCl溶液,得K2SiF6沉积,用塑料漏斗过滤并洗刷.
过程4:将K2SiF6转移至另一烧杯中,参加一定量蒸馏水,选用70℃水浴加热使其充沛水解(K2SiF6+3H2O=H2SiO3+4HF+2KF).
过程5:向上述水解液中参加数滴酚酞,趁热用浓度为cmol/LNaOH的标准溶液滴定至结尾,耗费NaOH标准溶液VmL.
①过程3中选用饱满KCl溶液洗刷沉积,其意图是洗去沉积外表的HF等杂质;增大K+浓度,削减K2SiF6的丢失.
②过程5中判别滴定结尾的现象是最终一滴滴入后溶液由无色变为粉赤色,且30s不褪色.
②当Fe3+刚好沉积彻底时,即c(Fe3+)<10-5mol/L,依据Ksp=c(Fe3+)c3(OH-)可核算得溶液中氢氧根离子的溶液,从而确认溶液的PH值;
(3)反响Ⅲ中生成Al(OH)3沉积是在偏铝酸钠溶液中通入过量的二氧化碳生成氢氧化铝沉积;
(4)①用饱满KCl溶液洗刷沉积能够洗去沉积外表杂质,削减K2SiF6沉积的丢失;
②氢氧化钠溶液滴定试验结尾判别为,滴入最终一滴氢氧化钠溶液变为赤色且半分钟内部改变怎样反响到达结尾;
③耗费氢氧化钠的物质的量是0.001Vcmol,则依据方程式K2SiF6+3H2O=H2SiO3+4HF+2KF和二氧化硅的含量表达式可知,反响中与氢氧化钠反响的应该是HF.
(2)①依据沉积的溶解平衡可知,溶度积常数越小,越简单沉积,所以依据表中数据可知,金属阳离子的沉积次序依次为Fe3+>Al3+>Mg2+,
(3)反响1中氧化铝和稀硫酸反响生成硫酸铝,然后参加过量的氢氧化钠生成偏铝酸钠,则过滤后再通入CO2即可生成氢氧化铝,反响的离子方程式是AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,
(4)①选用饱满KCl溶液洗刷沉积,其意图是洗去沉积外表的HF等杂质;增大K+浓度,削减K2SiF6的丢失,
故答案为:洗去沉积外表的HF等杂质;增大K+浓度,削减K2SiF6的丢失;
②因为碱液能使酚酞试液显赤色,所以过程5中滴定结尾的现象为最终一滴滴入后溶液由无色变为粉赤色,且30 s不褪色;
③耗费氢氧化钠的物质的量是0.001Vcmol,则依据方程式K2SiF6+3H2O=H2SiO3+4HF+2KF和二氧化硅的含量表达式可知,反响中与氢氧化钠反响的应该是HF,故选B.
点评本题首要考察二氧化硅的性质、氢氧化铝的制备及用处、中和滴定、化学试验根本操作以及物质含量的有关核算,中等难度,偏重对学生才能的培养和练习,有利于培养学生的逻辑推理才能和标准谨慎的试验规划才能及着手操作才能.
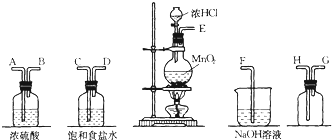
(3)在设备中:①饱满食盐水的作用是除掉Cl2中的HCl,②浓硫酸的作用是枯燥氯气.
(4)化学试验中查验是否有Cl2发生常用湿润的淀粉-KI试纸.如果有Cl2发生,可观察到的现象是试纸变蓝,写出反响方程式Cl2+2KI=I2+2KCl.
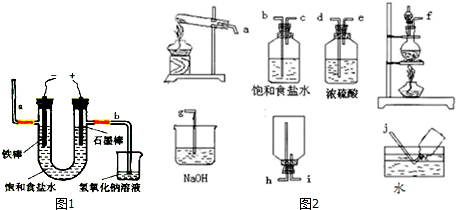
(2)粗盐提纯:粗盐中首要含有MgCl2、Na2SO4和CaCl2杂质,规划如下计划:

邻近变红.图中b端发生的气体怎么查验用湿润的淀粉碘化钾试纸查验,若变蓝则阐明是氯气
b.在①漂白粉②MgCl2③盐酸④氯气⑤铁⑥Na2O⑦稀硫酸⑧CO2⑨液氨⑩酒精中归于电解质的是②⑥(填序号,下同),归于非电解质的是⑧⑨⑩.
①在如图2的各设备中,选用必要的设备,制备纯洁枯燥的Cl2,并按从左到右的次序衔接仪器,用接口字母按次序衔接为:fbcdeihg.(图2设备不一定全部都运用)
②若将制得的Cl2通入碘化钠溶液中,现象是溶液由无色变为棕黄色,再往其间滴加四氯化碳家喻户晓、静置,现象是溶液分层,上层为挨近无色,基层为紫赤色.
上一篇:硅藻土特性
下一篇:硅藻土的首要成分docx